СТАТЬЯ
Профилактика репродуктивных нарушений при синдроме поликистоза
яичников (СПКЯ) у женщин репродуктивного возраста
Л.Н. Семенюк, О.В. Ларина
Украинский научно-практический центр эндокринной хирургии,
трансплантации эндокринных органов и тканей МОЗ Украины
В статье представлены новые данные о профилактике репродуктивных потерь при СПКЯ. Показана роль различных
неблагоприятных факторов внешней среды на формирование функционального гормонального дисбаланса при СПКЯ.
Склерополикистоз яичников рассмотрен с позиции мультифакториального заболевания. Повышение качества
репродуктивной функции женщин при котором возможно путем снижения токсического воздействия назначаемых
на прегравидарном этапе препаратов при комбинированном введении в организм веществ растительного
происхождения и оральных контрацептивов с антиандрогенным эффектом.
Summary
The paper presents new data on the prevention of reproductive losses in PCOS. The role of various
environmental factors on the formation of functional hormonal imbalance in PCOS. PCOS considered from
the perspective of multifactorial diseases. Improving the quality of women's reproductive function in
which it is possible by reducing the toxic effects of prescribed drugs on Pregravidarnaja stage in
the combined administration to a plant-derived substances and oral contraceptives with antiandrogenic effect.
Высокие показатели смертности в сочетании с низкой рождаемостью являются причиной серьезного
демографического кризиса в нашей стране. Несмотря на достижения медицинской науки в установлении
причин потерь беременности, а также бесплодия, эта проблема остается далекой от решения.
Беспорным является факт, что от упешности реализации первого гестационного дебюта зависят различные
факторы, влияющие на упешность будущих беременностей – от маточного, до эндокринного, так как почти 50%
нарушений менструального цикла и вторичного бесплодия манифестируют после потери первой беременности[3,5].
Функциональный гормональный дисбаланс, лежащий в основе самопроизвольных абортов 1-го триместра, чаще связан
с гипоэстроненией, гипопрогестеронэмией на этапе селекции доминантного фолликула, цитокиновым дисбалансом,
который является результирующим показателем нарушения работы систем детоксикации ксенобиотиков (прежде всего ЖКТ),
хрониостресса, который обусловлен многими факторами – от нарушения ритма сна-отдыха, до нарушения культуры питания,
гиподинамическим образом жизни, как результат сопровождается функциональной гиперкортизолэмией, гиперпролекинэмией,
диспитуитаризмом, недостаточностью уровня прогестеронингибирующего блокирующего фактора, снижением синтеза
секреторного иммуноглобулина А, повышением провоспалительных цитокинов при снижении уровня противовоспалительный,
активацией условно-патогенной флоры и повышенной контаминацией ею различных биотопов организма, что замыкает
провоспалительный каскадный иммунный механизм [8].
Становление менструальной функции современной женщины протекает на фоне психоэмоциональных стрессов,
сопровождающих современную жизнь, загрязнения окружающей среды и несовершенства пищевых технологий и т. д.
– факторов провоцирующих повышение расхода и уменьшение поступления витаминно-минеральных соединений в организм
современного человека. Результатом сочетанного эффекта неблагоприятных внешних факторов и индивидуальных
особенностей генома является развитие так называемых мультифакторных (сочетанных или комплексных) заболеваний (МФЗ).
На сегодня выделяется большая группа заболеваний, в патогенезе которых ведущим звеном принято считать влияние
токсических пищевых, техногенных и др. вредных факторов. Их нередко определяют как «экогенетические болезни».
Причина их возникновения кроется не только в ухудшении экологических условий, но и в повышенной индивидуальной
чувствительности к действию повреждающих факторов. Мутантные гены (аллели), которые совместимы с рождением и
жизнью, но при определенных неблагоприятных условиях способствуют развитию того или иного МФЗ получили название
«генов предрасположенности» [5,6].
Одним из наиболее распространенных заболеваний мультифакторной природы в эндокринной гинекологии есть СПКЯ.
Имея наследственную предрасположенность, заболевание манифестирует с клинической картиной различных патологических
процессов – от нарушения менструального цикла с хронической ановуляцией и гиперандрогенией, бесплодием или
невынашиванием беременности, до склонности к опухолеобразованию, ранней манифесации метаболического синдрома,
со всей его множественностью клинических проявлений[10].
Пути профилактики МФЗ болезней на сегодня распределены на несколько уровней:
Первичная профилактика называется также преконцепционной профилактикой. Она направлена на предупреждение
зачатия больного ребенка и включает комплекс мероприятий и рекомендаций, связанных с планированием деторождения.
Преконцепционная профилактика включает информирование супругов по вопросам гигиены брака, планированию ребенка,
назначение терапевтических доз фолиевой кислоты и мульти-витаминов до зачатия и на протяжении первых месяцев
беременности. Как показывает мировой опыт, такая профилактика позволяет уменьшить риск рождения детей с
хромосомной патологией и с дефектами нервной трубки.
Вторичная профилактика включает в себя весь комплекс скринирующих программ, инвазивные и неинвазивные
методы исследования плода, специальные лабораторные анализы плодного материала с помощью цитогенетических,
молекулярных и биохимических методов исследования с целью предупреждения рождения детей с тяжелыми хромосомными,
генными и врожденными пороками развития.
Третичная профилактика касается создания условий непроявления наследственных и врожденных пороков, методов
коррекции уже имеющихся патологических состояний. Она включает различные варианты нормокопирования.
В частности, такие как использование специальных диет в случае врожденных нарушений процессов обмена,
лекарственных препаратов, выводящих токсины из организма или замещающих отсутствующие ферменты, операции
по коррекции функции поврежденных органов и т. д.
Повышение качества репродуктивной функции может быть достигнуто и путем профилактики будущих серьезных
репродуктивных, гестационных нарушений путем снижения токсического воздействия назначаемых на прегравидарном
этапе препаратов путем введения в организм веществ растительного происхождения.
При этом необходимо учитывать состав таких препаратов, поскольку результаты научных исследований последних
лет свидетельствуют, что для достижения полной биологической ценности питания необходимо введение в состав
рациона не отдельно взятых витаминов, а правильно подобранных в количественном и качественном соотношении их
комбинаций между собой и с другими веществами. Это связано с тем, что многие химические процессы происходят
при участии одновременно нескольких взаимодействующих между собой веществ.
Мастолек – новый отечественный препарат, растительно-витаминный комплекс, оказывающий положительное влияние
на метаболизм эстрогенов. Безусловно, главным компонентом в составе «Мастолека» является индол-3-карбинол (ИЗК),
который эффективно воздействует на все виды эстроген-зависимых опухолей в т.ч. злокачественных, поражающих
органы женской половой сферы (в т.ч.молочную железу, матку, яичники), подавляет их рост регулирует метаболизм
эстрогенов, препятствуя образованию агрессивного 16-гидроксистерона с формированием гиперэстрогенемии.
ИЗК блокирует внутриклеточный путь передачи сигналов, поступающих от ростовых факторов и цитокинов,
которые в свою очередь подавляют избыточную пролиферацию, свойственную таким заболеваниям, как миома матки,
мастопатия, эндометриоз и т.д., индуцирует апоптоз в опухолевых клетках, избирательно подавляя развитие
клеток, подвергшихся трансформации и инфицированных вирусом папилломы человека (ВПЧ). Профилактический
прием ИЗК формирует устойчивую защиту организма на уровне клеток.
Применение индол-3-карбинола при поликистозе яичников связано с способностью его активирвать определенную
форму цитохрома Р-450(CYP 1A1), отвечающего за образование 2-гидроксипроизводных эстрадиола, и таким образом
восстанавливает нормальный баланс гидроксипроизводных эстрогенов: слабого эстрогенового агониста
2-гидроксиэстрона (2ОН-Е1) и патологического метаболита 16α-гидроксиэстрона (16-α- ОН- Е1), стимулирующего
клеточную пролиферацию. Механизмы антипролиферативного действия И3К реализуются посредством И3К– зависимого
ингибирования фосфорилирования тирозиновых остатков цитоплазматических протеаз, передающих сигнал с
поверхности клетки к ядру клетки (факторы роста EGF и IGF, ядерный фактор транскрипции NFckF) и
ингибирования им активности циклооксигеназы -2(СОХ-2), активирующейся в ответ на действие провоспалительных
цитокинов – фактора некроза опухоли альфа (TNF-α) и его «партнера» -интерлейкина IL -1[13].
Сочетание ИЗК с экстрактом брокколи (Brassica Oleracea Italica) важно в плане уселения эффекта броколи
подавлять рост раковых клеток. В ходе исследования, проведенного медиками из колледжа Джона Хопкинаса,
было установлено, что брокколи является источником глюкорафанина, который в организме превращается в
сульфорафан, который убивает бактерии, вызывающие некоторые виды язв желудка, а также препятствует
развитию злокачественных опухолей этого органа. При этом было отмечено, что сульфорафан убивает даже
те бактерии, которые невосприимчивы к антибиотикам. Исследования, проведенные японскими учеными показали,
что сульфорафан останавливает рост раковых клеток кожи. Также брокколи имеет выше описанный индол-3-карбинол,
(И3К), который признан учеными как эффективное средство для борьбы с раковыми клетками, действующее на них
как непосредственно, так и способного стимулировать иммунную противораковую защиту. Другой компонент
брокколи — синегрин, вещество, останавливающее деление раковых клеток и вызывающее их гибель. Женщины,
употребляющие продукты из брокколи регулярно – со временем отмечают не только снижение болей в молочной
железе, но и рассасывание ее мелких уплотнений. Также брокколи может оказывать полезное влияние на
сердечнососудистые, нейрологические заболевания и влиять на процессы старения. В настоящее время
врачи онкологи-маммологи могут обоснованно рекомендовать употребление капусты брокколи женщинам с
заболеваниями молочной железы. Они же включают этот сорт в диету при мастопатии. И не случайно.
Брокколи насыщена йодом и является прекрасным профилактическим средством против рака молочной железы.
Сочетание выше перечисленных веществ с экстрактом Витекса священного (Vítex agnus-castus) позволяет
«Мастолеку» влиять на функцию жёлтого тела (железы, регулирующей менструальный цикл).
Хотелось бы отметить, что в гинекологической эндокринологии широко применяются два растения,
для препаратов на основе которых были проведены двойные слепые плацебо контролированные исследования,
подтвердившие их соответствие критериям доказательной медицины. Клопогон кистевидный (cimicifuga racemosa),
который успешно используется для лечения климактерических нарушений и экстракт из плодов прутняка обыкновенного,
который был рекомендован для лечения временных нарушений менструального цикла, а также с целью купирования
симптомов предменструального синдрома, включая предменструальную мастодинию[25].Экстракт прутняка
обыкновенного успешно используется для смягчения предменструальной мастодинии, связанной с гиперпродукцией
пролактина, функциональной гиперандрогенией связанной с хроническим стрессом, который лежит в основе
многих эндокринных дисбалансов, приводящих, в итоге, к недостаточности лютеиновойфазы менструального
цикла, бесплодию, потерям беремености [25].
Следующим немаловажным компонентом «Мастолека» является корень одуванчика (Taráxacum), который содержит
ряд растительных антиандрогенов, что помогает:
• нормализовать гормональный фон;
• снизить излишнюю выработку тестостерона;
• блокировать выработку 5-альфа-редуктазы и превращения тестостерона в дегидротестостерона (ДГТ);
• повысить уровень глобулина, связывающего половые гормоны;
• нормализовать уровень сахара в крови и повысить чувствительность к инсулину (инсулинорезистентность
часто является причиной поликистоза и повышенной выработки ДГТ).
Корни одуванчика содержат терпены, стерины, полисахарид инулин (до 40%), холин, горькое вещество
лактукопикрин, каротиноиды – предшественники витамина А, витамины группы В, Е, аскорбиновую кислоту,
минералы (калий, кальций, марганец, железо, магний, медь, цинк, кобальт), аспарагин, дубильные вещества,
растительный белок (до 5%), жирное масло (состоящее из глицеридов олеиновой, мелиссовой, пальмитиновой,
линолевой и цератиновой кислот), простые углеводы (сахара). А также значительное количество инулина,
тараксастерол, псевдотараксастерол, гомотараксастерол, бета-амирин, бета-ситостерин, стигмастерин,
тараксал, лакулин, клугтионоль, инозит, аспарагин, Р-фенилуксусная кислоту, 3-4-диоксицианоминовая
кислота, глицериды олеиновой, мелиссовой, пальмитиновой, линолевой и цератиновой кислот в своем
комплексе также оказывают поддержку при гормональных заболеваниях и мастопатии.
Важным, и с нашей точки зрения, патогенетически оправданным, явилось включение в состав препарата
L-метионина (L-Methionine) - незаменимой аминокислоты, улучшающей обменные процессы в печени,
необходимой для поддержания роста и азотистого равновесия организма. L-метионин содержит
метильную группу, которая участвует в процессе переметилирования и необходима для синтеза
холина. За счет этого нормализуется синтез фосфолипидов из жиров и уменьшается отложение в
печени нейтрального жира. L-метионин участвует в обмене серосодержащих аминокислот, в синтезе
эпинефрина, креатинина и других биологически активных веществ, активирует действие гормонов,
витаминов (B12, аскорбиновой, фолиевой кислот), ферментов, белков. Участвует реакциях переметилирования,
дезаминирования, декарбоксилирования. Необходим для дезинтоксикации ксенобиотиков, что особенно
актуально для большинства женщин, пользующихся оральными контрацептивами, или проходящими курс
эстроген-заместительной терапии, из-за ослабления ферментативых процессов их организма, эстроген
метаболизируется в канцерогенный эстрадиол, который вызывает патологические пролиферативные процессы
в органах-мишенях (матка, яичники, молочные железы). L-метионин превращает канцерогенный эстрадиол в
менее опасную форму женского гормона – эстриол. Также эта аминокислота необходима для правильного
функционирования нервной системы, устраняет повышенную раздражительность, нервную лабильность
при ПМС и климактерическом синдроме. L-метионин оказывает выраженное антиоксидантное действие,
так как является источником серы, инактивирующей свободные радикалы. Сульфгидрильная группа
метионина защищает клетки от попадания внутрь токсических веществ, а также обеспечивает
транспорт селена и цинка[23].
В растительно-витаминном комплексе «Мастолека» представлены аскорбиновая кислота, витамины
А, Е, D, В2, В6, В12. Аскорбиновая кислота (витамин С) — активный участник регуляции
окислительно-восстановительных процессов в организме, обладает антиагрегантными и выраженными
антиоксидантными свойствами. Усиливает дезинтоксикационную функции печени, повышает
сопротивляемость организма инфекциям. Уменьшает токсичность лечебных средств и увеличивает
эффективность химио- и лучевой терапии при лечебном процессе. Витамины А, Е, D - необходимы
для полноценной работы яичников, нормализуют работу репродуктивной системы женщины, поддерживают
сексуальную активность.[20,21,22]
Витамин А оказывает влияние на рост человека, улучшает состояние кожи, способствует сопротивлению
организма инфекции, обеспечивает рост и развитие эпителиальных клеток, входит в состав зрительного
пигмента палочек сетчатки глаза - родопсина и зрительного пигмента колбочек - йодопсина.
Эти пигменты регулируют темновую адаптацию глаза. Биологическое действие витамина А: антиоксидантное,
иммуно-модулирующее, обеспечивающее нормальную структуру и функции эпителия и слизистых оболочек,
репаративное и ранозаживляющее, регулирующее уровень глюкозы в крови, регулирующее функции половых
желез, обеспечивающее метаболизм в сетчатке глаза, онкопротекторное. При недостатке витамина
А происходят нарушения в работе иммунной системы, сбои при функционировании эндокринной системы
и в защите от инфекций. Воздействуя на слизистые оболочки, ретинол повышает их устойчивость к
вирусам, увеличивает активность лейкоцитов, а так же способен защитить от инфекций мочеполовую
систему, дыхательные пути и желудочно-кишечный тракт[12].
Витамин D - это совокупность биологически активных веществ, похожих по химической структуре.
Все витамины группы D регулируют уровень фосфора и кальция в организме человека. В современной
медицине витамином D принято считать витамин D2 (эргокальциферол) и витамин D3 (холекальциферол).
В по следние годы появилось множество работ о влиянии витамина D на развитие инсулинорезистентности
и гиперандрогении. Все больше доказательств получает связь дефицита витамина D и ожирения.
Ведется поиск генетических маркеров предрасположенности к синдрому поликистозных яичников
среди полиморфизмов генов рецептора витамина D. Учитывая выявленную связь, терапия препаратами
витамина D может стать эффективным методом лечения этого заболевания. Помимо влияния на репродуктивную
функцию, витамин D участвует в регуляции циркадных ритмов, нарушение которых также может приводить к
развитию ановуляции - т.е., дефицит витамина D может способствовать реализации мультифакторной
природы заболеваний репродуктивной системы женщины[13,15,20].
Витамин Е (токоферол) - по химической структуре относится к группе спиртов. Токоферол - витамин
размножения, благотворно влияет на работу половых и некоторых других желез, восстанавливает
детородные функции, способствует развитию плода во время беременности и новорожденного ребенка.
Является природным противоокислительным средством, препятствует окислению витамина А и благотворно
влияет на накопление его в печени. Препятствует развитию процессов образования токсичных для
организма свободных радикалов и перекисей жирных кислот, окислительного повреждения липидов
мембран и клеточных структур. Витамин Е способствует усвоению белков и жиров, участвует в
процессах тканевого дыхания, влияет на работу мозга, крови, нервов, мышц, улучшает заживление ран,
задерживает старение[12].
В гинекологической практике заслуживает внимания через его высокие антиоксидантные качества,
он стимулирует продукцию простациклина и тем самым препятствует агрегации тромбоцитов у лиц с
диабетом, нейтрализуя эффекты простагландинов, оказывает клинический эффект при угрозе прерывания
беременности, дисменорее, предменструальном синдроме. Противоопухолевая активность токоферола
связана с его свойством блокировать превращение нитритов в нитрозамины, которые являются сильними
опухолевыми промоторами. Известны также иммуномодулирующие свойства витамина Е[1].
Витамины В2, В6, В12 - Витамины группы В в сочетании с селеном препятствуют нервному истощению
и укрепляют нервную систему. Витамин В2 (рибофлавин) стимулирует процессы регенерации и кроветворения,
регулирует функции печени и центральной нервной системы, участвует в обмене углеводов, жиров и белков,
клеточном дыхании и окислительно-восстановительных процессах.
Витамин В6 (пиридоксин) улучшает работу головного мозга, регулирует функции половых желез,
надпочечников, щитовидной железы, уровень в крови глюкозы. Обладает мочегонным, антидепрессантным,
антианемическим, гипотензивным, антиатеросклеротическим, противовоспалительным, иммуностимулирующим
действием. Витамин В6 способствует повышению уровня женского гормона - прогестерона - в крови.
Способствует синтезу эндорфинов - естественных стимуляторов настроения и эмоций, оказывая тем
самым благоприятное воздействие на симптомы климактерического периода и ПМС.
Витамин В12 (цианокобаламин) улучшает концентрацию внимания и память, повышает сопротивляемость
к простудным заболеваниям и вирусным инфекциям, оказывает антисклеротическое действие, принимает
участие в образовании аминокислот, кроветворении, синтезе ферментов, белковом, жировом и углеводном
обмене. Многими исследованиями установлено, что витамины А, С, Е и группы В при нарушении
менструального цикла участвуют в эстрогенном обмене и напрямую воздействуют на репродуктивную функцию.
Минералом, входящим в комплекс «Мастолек», выбран селен. Согласно современным представлениям
биологическая роль селена в первую очередь определяется его антиоксидантным и иммуномодулирующим
действием [23]. Как известно, влияние внешних оксидантов (радиация, ультрафиолет, химические
загрязнители воздуха, воды, продуктов питания, холодовые воздействия и многие другие факторы),
а также активация эндогенных механизмов генерации активных метаболитов кислорода и интенсификации
процессов перекисного окисления липидов (ПОЛ) при различных патологических состояниях приводят
к развитию так называемого окислительного стресса – важного патогенного фактора многих заболеваний.
Перечень этих заболеваний продолжает постоянно расширяться и включает в себя такие социально
значимые заболевания, как сердечно-сосудистые, бронхолегочные, онкологические и другие.
В условиях окислительного стресса имеет место напряжение системы антиоксидантной защиты организма,
которое требует восполнения антиоксидантов путем их поступления с пищей. Именно поэтому чрезвычайно
важно, чтобы наше питание обеспечивало ежесуточные потребности организма человека в антиоксидантах,
причем в определенных экстремальных ситуациях эти потребности могут существенно возрастать.
Круг природных антиоксидантов, как известно, весьма широк, и особое место в нем занимает
система глутатиона, ключевыми компонентами которой являются селенсодержащие ферменты –
глутатионпероксидазы I, II, III и IV [6]. Антиоксидантными функциями обладают также
селенопротеины Р и W [7]. Селеноэнзимом, ответственным за обмен тиреоидных гормонов,
является 5-йодтиронин деиодиназа I, что указывает на тесную связь обмена селена с обменом йода [13,23].
Знание этой связи обясняет высокую частоту патологии щитовидной железы у женщин Украины.
Сравнительно недавно выделена и идентифицирована селензависимая тиредоксинредуктаза,
главной биологической функцией которой является катализ окисления/восстановления
тиредоксина – белка, ответственного за поддержание окислительно-восстановительного
гомеостаза в клетке .Что касается иммуномодулирующего действия селена, то оно затрагивает
как гуморальное, так и клеточное звенья иммунной системы. В частности, дефицит селена в
организме снижает продукцию антител, нарушает дифференцировку тимоцитов
(снижает число CD8 + CD4-CD8-тимоцитов). В то же время в системах in vitro и in vivo показано,
что добавление селена повышает митогенную активность Т-клеток, фагоцитарную активность макрофагов [25].
Селен необходим для гармоничной работы репродуктивной системы женского организма, предупреждает
развитие воспалительных заболеваний женской половой сферы и способствует устранению их
последствий (в т.ч. спаечных процессов в малом тазу). Во всем мире проблемы использования
селена в рационе здорового человека и лечебно-профилактическом питании обсуждаются очень активно.
Накопленные к настоящему времени в мировой практике результаты эпидемиологических и клинических
исследований позволяют заключить, что дефицит селена в окружающей среде, обусловливающий его
низкое содержание в организме, способен вызвать прогрессирующее поражение миокарда (один из примеров
– селенодефицитная кардиопатия), нарушения репродуктивной функции у мужчин, сопровождать кистозный
фиброз поджелудочной железы, бронхиальную астму и ряд других патологий [4]. При пониженной
обеспеченности селеном и соответственно низком содержании этого элемента в крови возрастает
риск возникновения онкологических заболеваний. Селен оказывает детоксицирующее действие по
отношению к тяжелым металлам [23]. Обеспеченность селеном очень важна для людей, подвергшихся
воздействию радиоактивного йода и входящих в группу риска развития аденомы щитовидной железы.
Многочисленные исследования указывают на снижение содержания селена в сыворотке крови жителей
крупных промышленных городов. Недостаточность селена наблюдается в старческом возрасте, у детей,
получающих низкокалорийное и низкобелковое питание, при беременности [25].
Целью исследования стало изучение эффективности растительно-витаминного комплекса «Мастолек» в
профилактике репродуктивных потерь у женщин репродуктивного возраста.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Нами было обследовано 67 женщин в возрасте 18–24 лет с СПКЯ (I группа), биохимической
гиперандрогенией, которые наряду с гормональной коррекцией (КОК с антиандрогенным эффектом),
получали растительно-витаминный комплекс «Мастолек» по 1 таб х 2 раза в день, и 45 женщин,
получавшие только КОК (II группа). Группу контроля составила 31 здоровая женщина готовящаяся
к беременности. Хотелось бы отметить, что у всех обследованных беременностей в анамнезе не было.
Было изучено состояние гормонального фона до лечения и через 6 месяцев терапии. С целью изучения
функционального состояния системы гипофиз-яичники проводили исследование уровня гонадотропных
гормонов (фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ)) иммуноферментным методом с
использованием специальных тест-систем UBI (США), а также уровней эстрадиола и прогестерона
(тест-системы Equipar, Италия). Уровень ФСГ, ЛГ, пролактина и эстрадиола определяли
на 5–7 день менструального цикла.
Динамика показателей гормонального статуса до и после лечения на 5-7-й дни менструального цикла
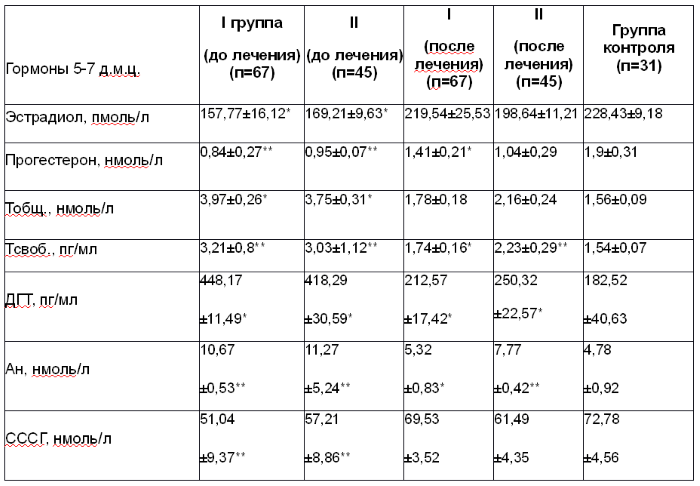
Р * <0,05 (достоверные различия значений до лечения по отношению к показателям после лечения)
Р ** (достоверные различия показателя после лечения по отношению к данным группы контроля.)
При оценке данных центральной регуляции репродуктивной системы на фоне проводимой терапии группе I
определено, что уровень ЛГ и диссоциация ЛГ / ФСГ значительно снизились на 43,1 и 40,3% соответственно,
что достоверно ниже данных полученных до лечения ( р <0,05) и соответствует уровню женщин контрольной группы.
Анализ уровня пролактина достоверно снизился только у женщин, получавших в комплексном лечении
растительно-витаминный комплекс «Мастолек» (І группа), при исходном 618,32±23,54 мкЕд/мл – после
лечения составил 313, 81±32,08 (р <0,05), что практически соответсвовало показателю группы контроля 316,29±31.
Показатель пролактина у женщин с традиционным лечением (ІІ группа) до лечения составлял 598,65±18,34,
после - 417,08 ±14,4 мкЕд/м (р>0,05)
В течение года после окончания лечения самостоятельно реализовали репродуктивную функцию 27 женщин
I группы и 4 - во II-й. Репродуктивных потерь в группе, получавших комплексную терапию КОК +
«Мастолек», небыло. Во второй группе самопроизвольными абортами в сроке 8-11 недель закончились
3 беременности , в одном случае – произошли преждевременные роды в сроке 34 недели гестации.
ВЫВОД
Результаты исследования свидетельствуют о хорошей эффективности растительно-витаминного комплекса
«Мастолек», что в сочетании с другими видами необходимых в каждом конкретном случае лекарственных
мероприятий (гормонотерапия, гомеопатические средства, фитопрепараты, препараты, улучшающие
кровообращение в регулирующих репродуктивную функцию органах, антистрессорная терапия и др.)
значительно увеличивает шансы женщины самостоятельно забеременеть и соответственно позволяет
родить здорового ребенка.
Полученные нами данные дают основания рекомендовать препарат «Мастолек» в комплексной терапии
женщин с СПКЯ при планировании беременности.
ЛИТЕРАТУРА
1. Е.Н.Борис., / БорисЕ.Н., Л.Н. Онищик., М.Н. Шпалько., А.В. Сербенюк Современные аспекты
применения витамина Е в практике акушера-гинеколога// 19.05.2011 МЕДФАРМКОННЕКТ.
2. Возможности негормонального лечения стресс-зависимых нарушений менструального цикла
// Материалы IX Всерос. науч. форума «Мать и дитя». Москва, 2-5 октября 2007. - С. 550-551.
3. Генетический паспорт – основа индивидуальной и педиктивной медицины. / В.С.Баранов,
«Издательство Н-Л», 2009. -528с.).
4. Дедов И.И., Андреева Е.Н., Карпова Е.А. Синдром поликистозных яичников. Эпидемиология.
Патогенез, диагностика и лечение. Практические рекомен- дации для врачей. Издание 2-е. М.: 2010.
5. Коколина В.Ф., Мельниченко Г.А. и соавт. // Репродукт. здоровье детей и подростков.
- 2006. - № 1. - С. 50-54.
6. Коколина В.Ф. Гинекологическая эндокринология детского и подросткового возраста.
- М.: Медпрактика-М, 2006.
7. Коколина В.Ф. Гинекологическая эндокринология детского и подросткового возраста.
- М.: Медпрактика-М, 2011.
8. Иванов И.И / Экологические аспекты репродуктивных потерь//Иванов И.И., Черипко М.В.,
Могилевская А.А Таврический медико-биологичкский вестник. – 20013. - № 2, - том 16.ч.2. – С. 181 – 187
9. Жукова Н.П. |Прогнозирование репродуктивного здоровья девушек-подростков и женщин
резерва родов: Автореф. дис. ... д-ра мед. наук.– Мн., 2002
10. Синдром поликистозных яичников. Под ред. Дедова И.И., Мельниченко Г.А. М.: МИА, 2007.
11. Тутельян В.А/ Селен в организме человека// Тутельян В.А., Княжев В.А., Хотимченко С.А.,
Голубкина Н.А., Кушлинский Н.Е., Соколов Я.А.. М., изд. РАМН. 2002; 224 с.
12. Шалунов С.С., Шенин В.А. и соавт. /Роль полиморфных генов в развитии синдрома
поликистозных яичников// Сибирский медицинский журнал. – 2011. – 5-8
13. Шереметьева Е.В. Метаболические риски и психологические особенно- сти больных при
различных фенотипах синдрома поликистозных яичников. Автореф. дис. … канд. мед. наук. М.,
14. Ших, Е. В. Эффективность витаминно-минеральных комплексов с точки зрения взаимодействия
микронутриентов / Е.В. Ших // Фармацевтический Вестник. — 2004. — № 37 (358).
15. Хузиханов Ф.В. и др. Обоснование выбора лечебного воздействия при дисменорее с учетом
гормонального статуса подростков. Медико-социальные аспекты репродуктивного здоровья
девочек 12-16 лет // Казан. мед. журн. - 2003. - Т. 84, № 2. - С. 148-149.
16. Ajayi, R., Okhowat, J., Spitzer, D., Schechinger, B., Zech, N.H. “Effect of multivitamin
antioxidant complex Fertilovit sperm quality, according to the criteria of the morphological
analysis of motile sperm organelle (MSOME).” JBRA Assisted Reproduction, 17(1) (2013): 27–3
17. Berkovitz S, Ambler G, Jenkins M, Thurgood S. Serum 25-hydroxy vitamin D levels in
chronic fatigue syndrome: a retrospective survey. International journal for vitamin
and nutrition research. 2009;79:250–254.
18. Compston JE, Vedi S, Ledger JE, Webb A, Gazet JC, Pilkington TR. Vitamin D status
and bone histomorphometry in gross obesity. American Journal of Clinical Nutrition. 1981;34:2359–2363.
19. Harlow BL, Signorello LB, Hall JE, Dailey C, Komaroff AL. Reproductive correlates of
chronic fatigue syndrome. The American journal of medicine. 1998;105:94S–99S.
20. Hoeck AD, Pall ML. Will vitamin D supplementation ameliorate diseases characterized
by chronic inflammation and fatigue? Medical hypotheses. 2011;76:208–213.
21. Kamycheva E, Joakimsen RM, Jorde R. Intakes of calcium and vitamin D predict body
mass index in the population of Northern Norway. Journal of Nutrition. 2003;133:102–106.
22. Li HW, Brereton RE, Anderson RA, Wallace AM, Ho CK. Vitamin D deficiency is common
and associated with metabolic risk factors in patients with polycystic ovary syndrome.
Metabolism. 2011;60:1475–1481.
23. Mahmoudi T. Genetic variation in the vitamin D receptor and polycystic ovary
syndrome risk. Fertility and Sterility. 2009;92:1381–1383.
24. Mahmoudi T, Gourabi H, Ashrafi M, Yazdi RS, Ezabadi Z. Calciotropic hormones,
insulin resistance, and the polycystic ovary syndrome. Fertility and Sterility. 2010;93:1208–1214.
25. Marla EL, Donna RC, Roger AP. Diagnostic Criteria for Polycystic Ovary Syndrome:
Pitfalls and Controversies. J Obstet Gynaecol Can. 2008;30:671–679.
26. www.reproduct-endo.com.ua No1 (9) / март 2013 61гинекология источник:
Wuttke W., seidlova-Wuttke D., Jarry H., a rtymuk n.Der stellenwert des
Monchspfeffers (Vitex agnuscastus). Zeitschrift für Phytotherapie 2010;
31: 294-298.перевод: Михаил Фирстов



